|
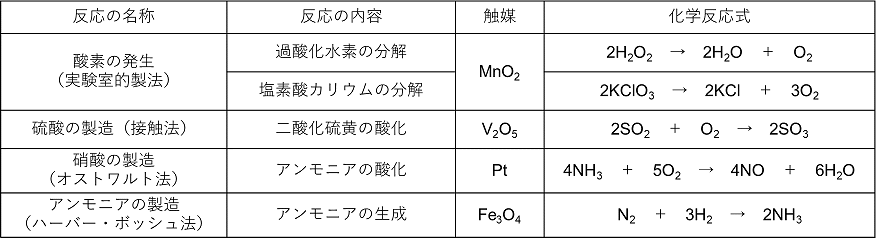
3 反応条件と反応速度h
【濃度の影響】
反応物質の濃度が高いと粒子の衝突する頻度が高くなるので,反応速度は大きくなる。
例)H2 + I2 → 2HI
この反応の場合,反応速度はH2とI2のモル濃度に比例することが実験により分かっている。比例定数をk とし,これを式で表すと〔 v=k[H2][I2] 〕となる。この式を〔 反応速度式 〕,k を〔 反応速度定数 〕という。また,v=k[H2]や v=k[I2]のような反応速度が濃度の1乗に比例する反応を〔 一次反応 〕,v=k [HI]2やv=k [H2] [I2]のような反応速度が濃度の2乗に比例する反応を〔 二次反応 〕という。
気体の場合,圧力(分圧)を高くすると,ボイルの法則より体積が小さくなり,単位体積中の分子数が増えるため,反応する分子どうしの衝突する回数が増えるので反応速度は大きくなる。(これは溶液の濃度を大きくするのと同じである)
|
|
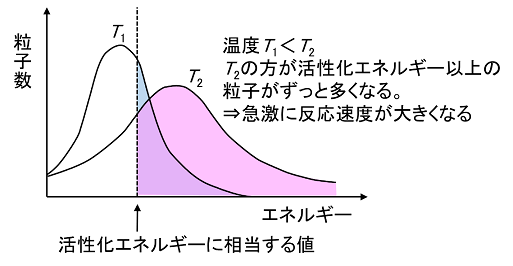
【温度の影響】
温度を上げると分子の熱運動が大きくなり,衝突回数が増えることが考えられるが,それだけではない。温度が高くなると分子の運動エネルギーの分布が変わる(高いエネルギーをもつ分子が増加する)。このため,活性化エネルギー以上のエネルギーをもつ分子数が増え,分子が衝突したときに反応が進む割合が大きくなり,反応速度は急激(10℃上がると2〜3倍になる)に大きくなる。
|
 |
|
|
例題
A
+ B → 2Cの反応がある。25°CではCの生成速度vは,Aのモル濃度[A]だけを2倍すると2倍に,Bのモル濃度[B]だけを2倍にすると4倍になった。また,温度を10K上げることに,Cの生成速度は3倍になった。
(1) 反応速度定数をkとして,vと[A]および[B]との関係を表す反応速度式を示せ。
(2) [A],[B]をいずれも3倍にすると,vは何倍になるか。
(3) 温度を30K上昇させるとCの生成速度は何倍になるか。
(1) v=k[A][B]2 (2) 3×32=27〔倍〕 (3) 33=27〔倍〕
|
|
例題
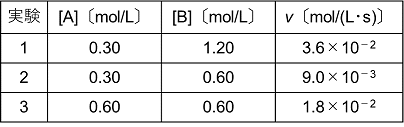
A + B → Cで表される反応がある。AとBの濃度を変えて,それぞれ反応速度を求め,表のような結果を得た。[A]=0.40〔mol/L〕,[B]=0.90〔mol/L〕のときの反応速度を求めよ。
|
 |
|
|
表の値より,[A]だけを2倍にする(実験2と3を比較する)とvは2倍になる。また,[B]だけを2倍にする(実験1と2を比較する)とvは4倍になる。これを反応速度式で表すと,v=k[A][B]2となる。この式に実験1〜3のいずれかを代入して反応速度定数kを求めると, k=3.6×10−2/(0.30×1.202)
=0.0833となる。問題の求める反応速度は,v=k[A][B]2より,v=0.0833×0.40×0.902=0.0269=2.7×10−2〔mol/(Ls)〕。
|
|
例題
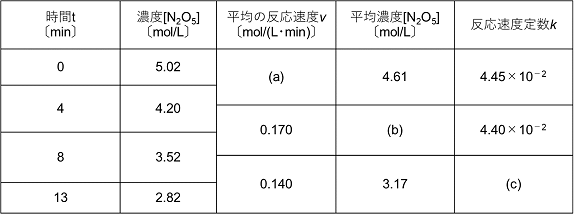
次の表は,体積一定のもとで,温度を320Kに保ち,五酸化二窒素の分解反応 N2O5
→ N2O4 +1/2O2を行ったデータである。
(1) 表の空欄に適当な数値を記せ。
(2) この実験データから,五酸化二窒素の分解における反応速度式はv=k[N2O5]で表される。反応速度定数kの値を単位とともに記せ。
|
 |
|
(1) (a) 0.205 (b) 3.86 (c) 4.42×10−2 (2) 4.42×10−2 1/min
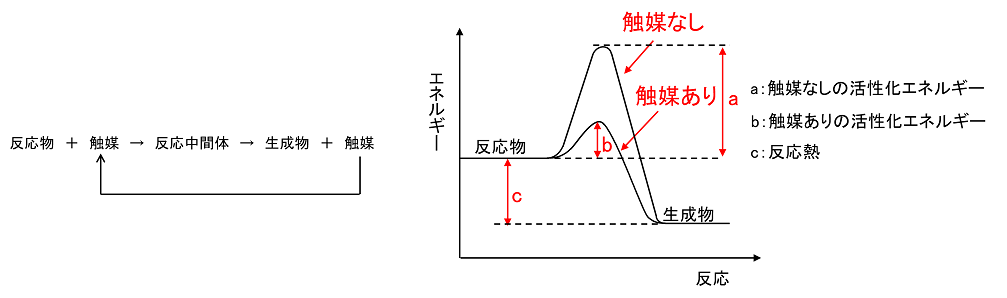
【触媒の影響】
反応物質に共存させると,自身は変化しないが,反応速度を変化させる物質を触媒という。触媒は反応物と低エネルギーで結合して,反応中間体をつくり,これから生成物ができるとともに,触媒が再生する。そのため,触媒がないときよりも活性化エネルギーが小さくなるので反応速度は大きくなる。しかし,反応熱は変わらない。
|
 |
|
触媒が反応物と均一に混合した状態ではたらく場合,これを均一触媒という。また,触媒が均一に混合しない状態ではたらく場合,これを不均一触媒という。
|
 |
|
酵素
消化などの生体内の化学変化を触媒する物質を酵素という。酵素の主成分は〔 タンパク質 〕である。
|
|
例題 次の文を読み,下の問に答えよ。
下の図は,可逆反応2A2B(気体)? 2A2(気体)+ B2(気体)について,反応経路に沿ったエネルギーの変化を示したものである。この反応は,温度を10K上げるごとに,反応速度が2倍になる。
(1) 図中のE1,E2は,それぞれ何といわれるか。また,Xの状態は何といわれ
るか。
(2) 逆反応の活性化エネルギーはいくらか。
|
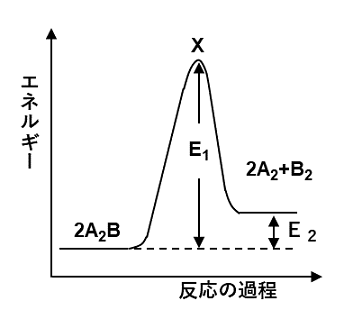 |
(3) A2B分子の解離反応は,発熱反応か,それとも吸熱反応か。判断の根拠も簡単に述べよ。
(4) 20℃において,20分で反応が終了するとすれば,50℃では何分かかるか。
(5) この反応に触媒を加えると,反応速度が著しく大きくなった。このとき,図中のE1,E2の値は,それぞれどのように変化するか。次から選べ。 (ア)大きくなる (イ)変わらない (ウ)小さくなる
|
|
(1) E1 活性化エネルギー E2 反応エンタルピー X 遷移状態 (2) E1−E2
(3) 吸熱反応 生成物の方が反応物よりもエネルギーが高いから。
(4) 2.5分 (5) E1(ウ) E2(イ)
|
 |